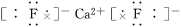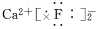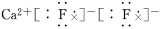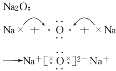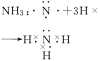共价键vs离子键:高中化学键类型与区别精讲
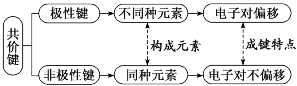
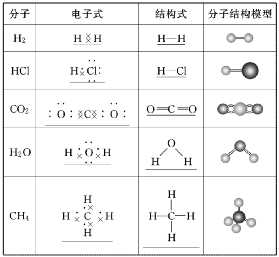
离子键1、离子键和离子化合物2、电子式的书写(1)一个“·”或“×”代表一个电子,原子的电子式中“·”(或“×”)的个数即原子的最外层电子数。(2)同一原子的电子式不能既用“×”又用“·”表示。(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaF2要写成(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能出现“===”。“―→”前是原子的电子式,“―→”后是化合物的电子式。共价键1、共价键(1)概念:原子间通过共用电子对所形成的相互作用。(2)成键三要素①成键粒子:原子;②成键本质:共用电子对;③成键元素:一般是同种或不同种非金属元素。(3)分类2、共价化合物(1)概念:以共用电子对形成分子的化合物。(2)四类常见物质①非金属氢化物,如HCl、H2O等;②非金属氧化物,如CO2、SO3等;③含氧酸,如H2SO4、HNO3等;④大多数有机化合物,如甲烷、酒精等。3、常见的以共价键形成的分子及其结构3.离子键与共价键的区别
| 离子键 | 共价键 | |
|---|---|---|
| 概念 | 带相反电荷离子之间的静电作用 | 原子间通过共用电子对所形成的相互作用 |
| 成键元素 | 活泼金属元素和活泼非金属元素之间 | 非金属元素之间 |
| 成键微粒 | 阴、阳离子 | 原子 |
| 成键条件 | 一般是活泼金属与活泼非金属化合时,易发生电子的得失形成离子键 | 一般是非金属元素的原子最外层电子未达到稳定状态,相互间通过共用电子对形成共价键 |
| 影响因素 | 离子的半径越小,所带电荷数越多,离子键越强 | 原子半径越小,共用电子对数越多,共价键越牢固 |
| 形成过程举例 | ||
| 存在范围 | 只存在于离子化合物中 | 可存在于非金属单质、共价化合物及部分离子化合物中 |
免责声明:本文来自靓仔选手,不代表新编百科网的观点和立场,如有侵权请联系本平台处理。